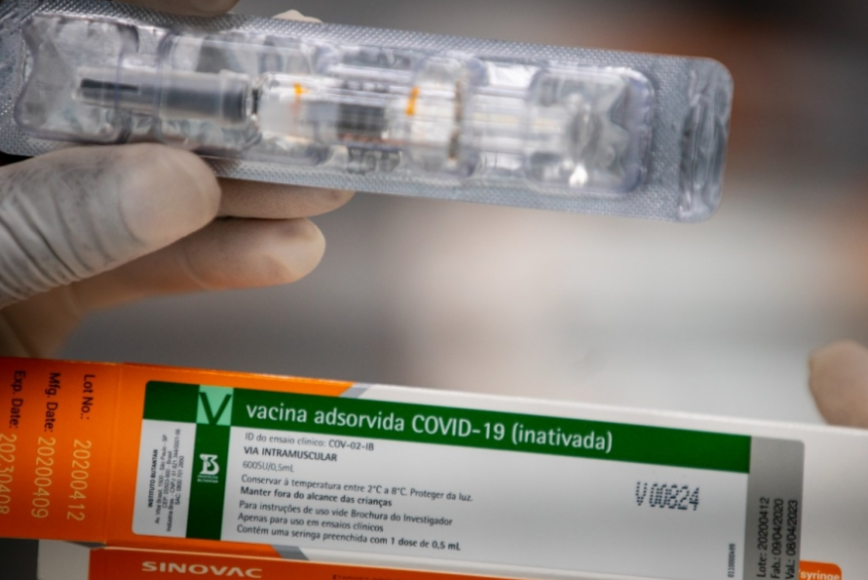
Anvisa recebe pedido do Butantan para uso emergencial da CoronaVac
A documentação foi entregue pelo Instituto Butantan na manhã desta sexta-feira. A primeira fase de análise da agência de vigilância terá duração de 24h
Quanto tempo a Anvisa tem para autorizar o uso da CoronaVac?
O @butantanoficial enviou à Anvisa nesta manhã o pedido de autorização de uso emergencial da Vacina do Butantan contra a Covid-19. A Anvisa fará a análise do uso emergencial em até 10 dias. A vacina comprovou sua eficácia e segurança e agora poderá imunizar milhões de brasileiros
— João Doria (@jdoriajr) January 8, 2021
Índice de eficácia da CoronaVac
Quando sai o registro definitivo da CoronaVac pela Anvisa?

