Anvisa decide até domingo o uso emergencial das vacinas da Covid
CoronaVac e a AstraZeneca são as vacinas contra Covid-19 que aguardam autorização emergencial da Anvisa. Veja como está a situação de cada uma
AstraZeneca, Coronavac, Pfizer ou BioNtech. Estas são as vacinas contra Covid-19 que o brasileiro está à espera. Todas estão em fase de aprovação pela Agência Nacional de Vigilância Sanitária – Anvisa, que deu previsão de autorização emergencial das vacinas contra Covid-19 até o próximo domingo (17).
Veja a situação das vacinas contra Covid-19 no Brasil:
CoronaVac
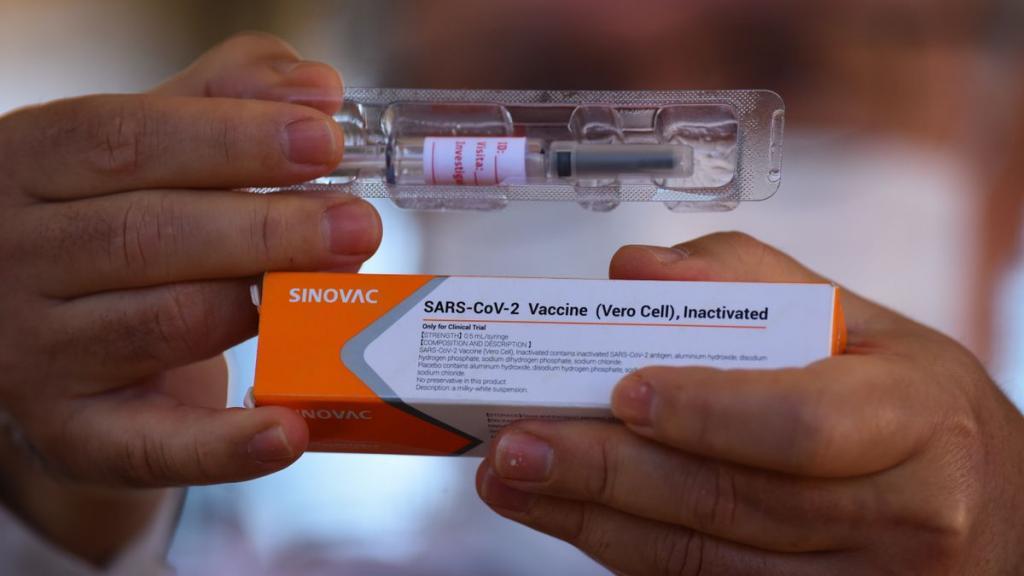
A vacina CoronaVac, produzida pelo Instituto Butantan em parceria com o laboratório chinês Sinovac está a espera da autorização da Anvisa para realizar a imunização no Estado de São Paulo no próximo dia 25 de janeiro – data estimada pelo Plano Estadual de Imunização. Porém, logo após o pedido emergencial feito na semana passada, o Instituto deve entregar alguns documentos pendentes para obter a autorização.
“Toda a documentação será entregue ainda nesta semana. O fato de a Anvisa solicitar mais informações, que estão sendo prontamente atendidas pelo Butantan, não afeta o prazo previsto para autorização de uso do imunobiológico. Os pedidos de novos documentos ou mais informações são absolutamente comuns em processos como esses”, disse o Butantan em nota. O instituto alegou também que tem feito uma ‘força-tarefa’ para apresentar todos os dados solicitados.
Até o momento, 5,47% da documentação ainda não foi apresentada, segundo site de monitoramento lançado pela agência. Até esta terça-feira, 40,7% da análise já fora concluída, e apenas 33,7% estava pendente de complementação. Outros 20,13% ainda estavam sendo estudados.
O relatório de imunogenicidade é um dos documentos pendentes que o Instituto Butantan tem de encaminhar à Anvisa. Segundo informações, o conteúdo diz sobre a capacidade de uma substância provocar uma resposta imune à quem for receber a vacina contra Covid-19.
A CoronaVac é uma das vacinas contra Covid-19 sendo produzida no Brasil. Ela apresentou uma aprovação de 50,38% de eficácia. O mínimo exigido pela Anvisa é de 50%, portanto a vacina atende os padrões da Organização Mundial da Saúde – OMS.
Os pesquisadores afirmam que 0,3% dos voluntários apresentaram reações alérgicas e não foram registrados efeitos adversos mais graves.
AstraZaneca/Oxford
A vacina contra Covid-19 de Oxford/AstraZeneca que será mantida pela Fiocruz está prevista para chegar no Brasil no dia 20 de janeiro. Serão importadas 2 milhões de doses prontas dessa vacina.
A taxa de eficácia da vacina da AstraZeneca é de 70,4%. A Fiocruz encaminhou pedido de urgência da vacina contra Covid-19 à Anvisa no último sábado (07), porem a agência informou que não há informação de relatórios que ainda não foram enviados. Até o momento, 32,39% da análise já foi concluída, e outros 53,17% estão em análise.
Segundo a presidente da Fiocruz, Nísia Trindade Lima, assim que a vacina chegar ao país, deve ser aplicada em até cinco dias na população. “[Depois que as doses chegarem da Índia], a vacina passa por um processo de rotulagem que leva em torno de um dia. A distribuição é será pelo Plano Nacional de Imunização- PNI, que precisa de três a quatro dias. Então, da chegada das doses ao processo de distribuição e início da vacinação, demora um período de cinco dias”, “, afirmou Nísia ao GloboNews.
A vacina Oxford/AstraZeneca está sendo importada do Instituto Serum, fabricante indiano contratado para produzir 1 bilhão de doses do imunizante a países em desenvolvimento
Pfizer/BioNtech – vacina contra Covid-19
Já a vacina da Pfizer/BioNTech já está sendo aplicada em vários países, mas ainda não pediu registro de uso no Brasil. A Anvisa realizou nesta terça-feira (12) uma nova reunião com representantes da Pfizer, empresa que fabrica a vacina produzida em parceria com o laboratório BioNtech e negocia venda de doses do imunizante para o Ministério da Saúde.
Ela tem 95% de eficácia geral e para imunizar a população, será necessária cada indivíduo tomar duas doses.
Em nota, a Anvisa informou que ‘no encontro, representantes da Anvisa esclareceram dúvidas e orientaram os representantes da empresa sobre o pedido de uso emergencial para a vacina’.
Na semana passada, o ministro da Saúde, Eduardo Pazuello, pediu condições especiais para comprar as 70 milhões de doses ofertadas ao Brasil pela Pfizer em 15 de agosto. A farmacêutica disse que negocia a venda de vacinas com o Brasil desde junho do ano passado. Ela já está sendo aplicada em 12 países, na União Europeia e países latino-americanos.
Leia mais:

